2025年1月26日,国家药监局药品审评中心(CDE)官网公示,中硼医疗旗下中硼(厦门)生物医药有限公司自主研发的1类新药NBB-002临床试验申请获批(受理号:CXHL2401242)。
该药物作为“全球新”创新药,是全球首个获批进入注册临床试验阶段的BNCT伴随诊断药物,也是中硼医疗继自研BNCT治疗药物“注射用硼 [10B] 法仑”(BPA)IND申请获批后,再次实现的重大突破,成为BNCT临床开发领域的又一标志性成果。

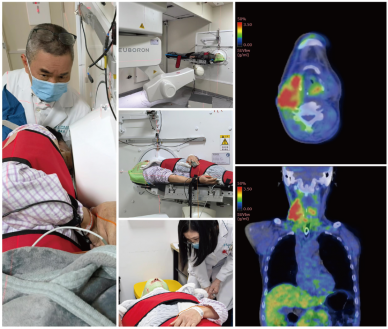
早在2024年4月,中硼医疗便凭借自研BNCT系统(极锋刀NeuPEX系统)及首个含硼靶向治疗药物(BPA),在厦门弘爱医院开展了BNCT药械联合I期注册临床试验。在主要研究者(PI)潘建基教授和黄诚教授的带领下,该临床试验分为Ia剂量爬坡和Ib剂量扩展两个关键阶段。目前,厦门弘爱医院已顺利完成Ia阶段临床试验,入组患者整体显示良好的安全性、耐受性,初步显示良好的临床疗效;Ib阶段临床试验也已正式启动,于1月20日完成了首批三位患者治疗,状态良好。
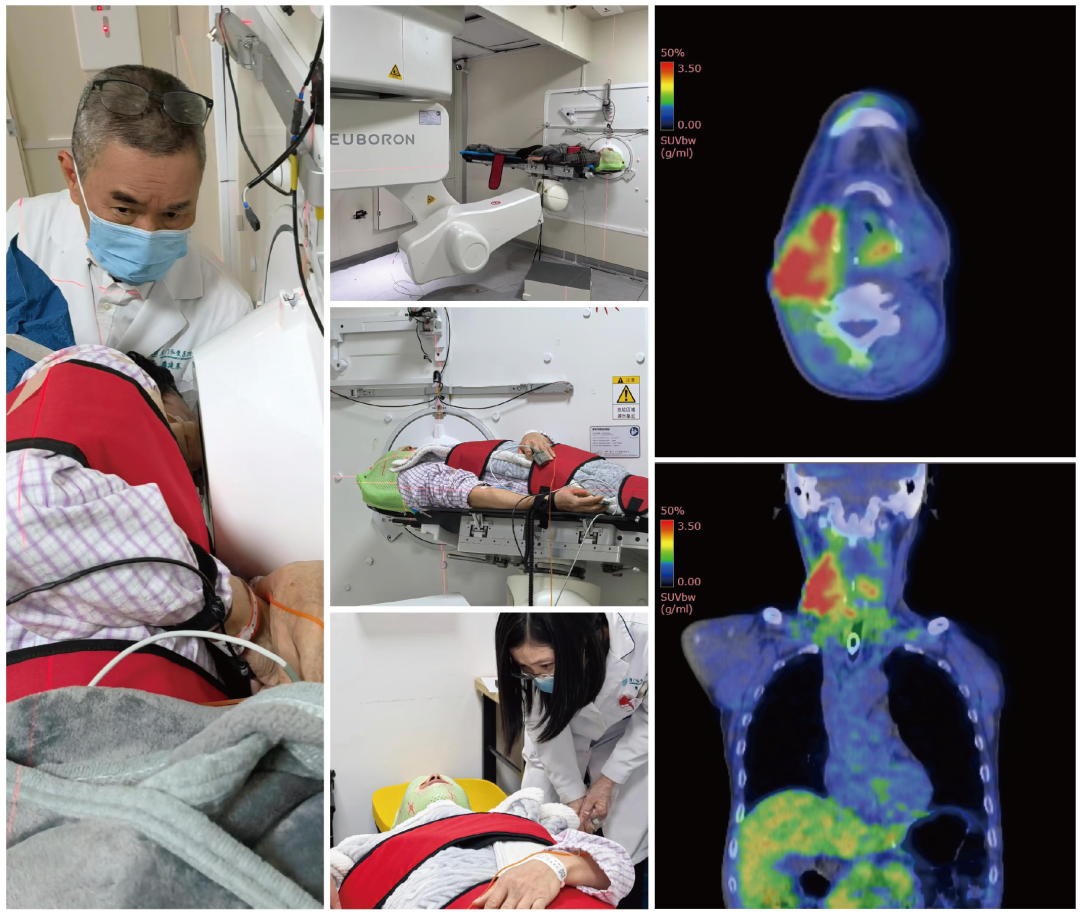
此次中硼医疗自主研发的含氟[18F]同位素的BNCT伴随诊断药物,为化药1类创新药,其适应症为:用于正电子发射断层显像(PET),利用肿瘤LAT1过度表达对实体肿瘤进行定位诊断和评估。
2022年,中硼医疗成功开发高收率的18F-BPA合成路线,单次合成的生产产量可实现商业化配送,并携手战略合作伙伴东诚药业旗下的东诚安迪科、米度生物等进行临床前相关研究工作。此外,中硼医疗还与北京协和医院霍力主任以及华中科技大学同济医学院附属同济医院朱小华主任合作,完成了大量人体临床研究(IIT),获得了早期的安全性研究数据,为NBB-002的申报积累了前期研究数据。
通过使用伴随诊断药物,可以进一步发挥影像的关键性指导作用,对BPA-BNCT的患者筛选、剂量计算精确性、随访跟踪等,起到重大作用;同时在厦门弘爱医院BNCT中心的前期研究表明,经过早期筛选通过的患者具有更高的临床获益可能性。
本次中硼医疗国产新药BNCT用放射性诊断药物的成功临床获批,以及国产BPA Ib期注册临床试验的正式启动,标志着我国在BNCT临床转化与应用方面接连取得具有里程碑意义的重大突破。未来,中硼医疗将联合厦门弘爱医院,进一步推动BNCT产品上市及临床应用进程,让先进技术尽早惠及更多患者。